Для оценки выживаемости в группу исследования было включено 32 иммунизированных пациентов с IV стадией меланомы. Группу контроля составили 32 пациента, получавших традиционное лечение.














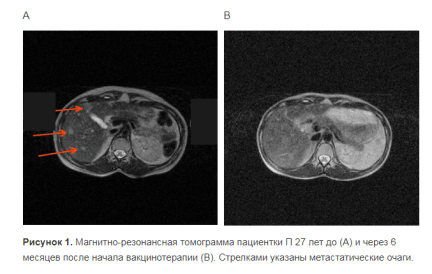
Для оценки выживаемости в группу исследования было включено 32 иммунизированных пациентов с IV стадией меланомы. Группу контроля составили 32 пациента, получавших традиционное лечение.
Эта группа была сопоставима с опытной группой по локализации и распространенности опухолевого процесса, полу, возрасту, а также времени наблюдения после генерализации процесса (таблица 1).
| Исследование | Контроль | |
|---|---|---|
| Мужчины/женщины | 10/22 человек | 10/22 человек |
| Средний возраст, года (возрастной диапазон) | 48.8 (18-69) | 48.2 (24-77) |
| Локализация метастатических очагов: | ||
| Лимфатические узлы, кожа, мягкие ткани | 23 (70%) | 26 (81%) |
| Легкие | 10 (31 %) | 6 (19 %) |
| Печень | 7 (21 %) | 7 (21 %) |
| Другие органы | 7 (21 %) | 8 (25 %) |
| Предшествующее лечение: | ||
| Операция | 17 (53 %) | 16 (50 %) |
| Операция + химиотерапия | 9 (28 %) | 10 (31 %) |
| Операция + иммунотерапия (интерферон) | 0 (0 %) | 1 (3 %) |
| Операция + химиотерапия + иммунотерапия (интерферон) | 2 (6 %) | 2 (6 %) |
| Операция + химиотерапия + физиотерапия | 2 (6 %) | 0 (0 %) |
| Операция + химиотерапия + лучевая терапия | 1 (3 %) | 0 (0 %) |
| Без лечения | 1 (3 %) | 3 (9 %) |
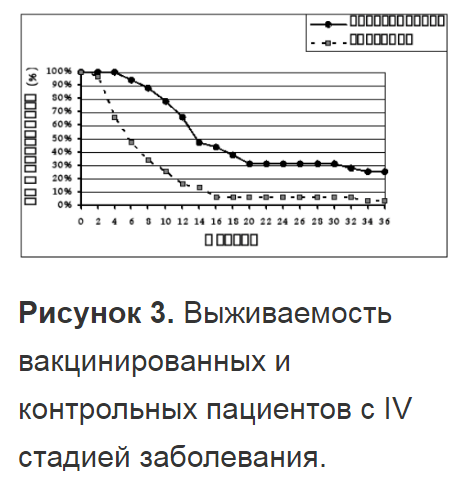
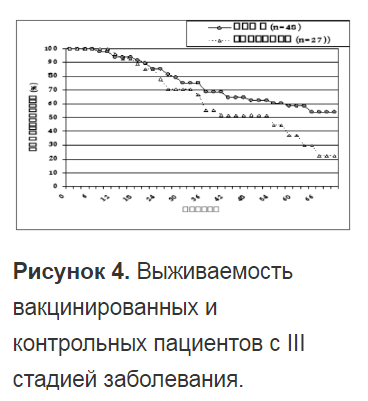
Таким образом, ксеновакцинотерапия может быть наиболее эффективно использована для профилактики развития рецидива у пациентов, подвергшихся условно радикальному хирургическому лечению.
Поскольку иммунотерапия не имеет серьезных побочных эффектов и не ограничивает жизненную активность пациентов, ее целесообразно начинать уже в дооперационном или раннем послеоперационном периоде.
Пациентка П, 27 лет, обратилась в лечебное учреждение по поводу изъязвления пигментного образования в области грудной клетки размером 1.0 х 1.5 см. Была прооперирована. По данным гистологического исследования был диагностирован эпителиоидно-клеточный вариант меланомы (III стадией инвазии по Кларку, глубина прорастания – 2 мм). Через 2 месяца после обращения по данным УЗИ было выявлено увеличение подмышечных лимфоузлов слева до 1,5 см. Была выполнена подмышечная лимфоаденэктомия, гистологически выявлены MTS меланомы. Через 2 месяца после операции по данным УЗИ в печени были обнаружены вторичные изменения в виде множественных очагов до 18 мм в размере. По данным МРТ было отмечено увеличение лимфоузлов средостения. Была проведена общая управляемая гипертермия ( 43,30 С). По данным УЗИ множественные очаги в печени сохранялись. Была начата вакцинотерапия в усиленном режиме. В это время имели место жалобы на выраженную слабость, повышенную утомляемость. В общем анализе крови отмечался относительный лимфоцитоз (41%). После каждой вакцинации в течение суток регистрировалось повышение температура до 38 0 С.. На следующий день в месте введения вакцины отмечалась гиперемия до 15 см в размере и болезненность.
Пациентка Д, 44 года травмировала родинки левого надплечья, которые долго кровили. Через 3 месяца было отмечено увеличение подмышечных лимфоузлов слева и на основании данных биопсии был поставлен диагноз: меланома. Было выполнено оперативное иссечение опухоли левого надплечья (III - IV стадии инвазии, толщина 6 мм) и пораженных лимфоузлов (в апреле 2000 г.). После оперативного лечения была начата вакцинотерапия, которая проводилась в усиленном режиме. Лечение переносила хорошо, без побочных реакций. На следующий день после вакцинации в месте инъекции наблюдалось покраснение диаметром 5-6 см. Через 3 месяца после начала вакцинотерапии (в июне 2000 г.) было выполнено иссечение 11 мягкотканных MTS, локализованных в разных участках тела. Вакцинотерапия была продолжена в усиленном режиме. Была отмечена регрессия множества мелких (до 5 мм в диаметре) внутрикожных MTS.
Через 3 месяца после начала иммунотерапии состояние пациентки оставалось стабильным, в крови сохранялся относительный лимфоцитоз (43 %). По данным компьютерной томографии было отмечено исчезновение вторичных изменений в печени и уменьшение лимфоузлов средостения. Состояние оставалось стабильным в течение последующих 11 месяцев. К концу этого периода лимфоузлы средостения уменьшились в своих размерах до нормы. Через год после начала иммунотерапии была отмечена прогрессия заболевания, проявившая себя в виде появления множественные подкожных MTS в левой и правой молочной железе, а также на левом плече. MTS были удалены оперативным путем, после чего вакцинотерапия продолжена по усиленной схеме. Была достигнута ремиссия продолжительностью 10 месяцев, до появления одиночного MTS в поясничной области справа, который был удален оперативным путем. В результате проведения усиленных курсов вакцинотерапии была достигнута долговременная полная ремиссия. Через 3.5 года после начала вакцинотерапии состояние пациентки было удовлетворительным, жалоб не отмечено, данных за прогрессию заболевания не выявлено.
Была достигнута ремиссия длительностью 1 год. MTS, развившийся в области послеоперационного рубца был оперативно удален и вакцинотерапия была продолжена в усиленном режиме. В течение последующих 2 лет данных за прогрессию заболевания отмечено не было. По истечению этого периода были выявлены MTS в левой молочной железе, в связи с чем была выполнена секторальная резекция пораженной ткани. Вакцинотерапия была продолжена по усиленной схеме. В результате была достигнута полная ремиссия. Через 4 года после начала вакцинотерапии состояние пациентки оставалось удовлетворительным, признаков заболевания отмечено не было, беспокоил лимфостаз в левой руке.
Из представленных примеров следует, что прогрессия заболевания не может являться причиной для прекращения иммунотерапии.